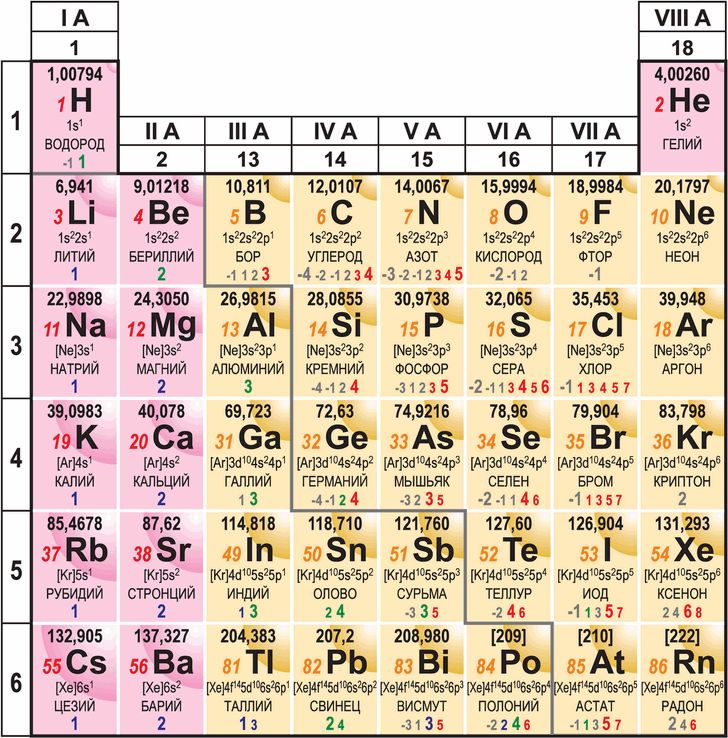
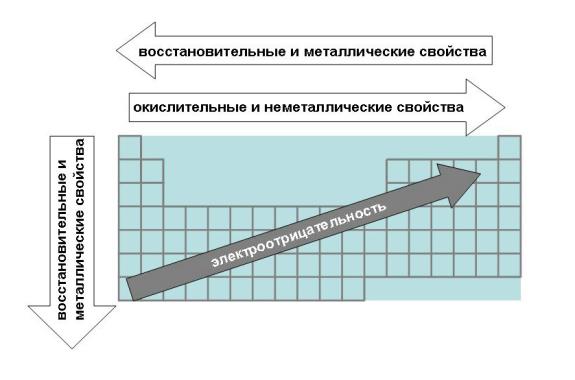
Почему в периоде радиус атома уменьшается

Химия. 11 класс
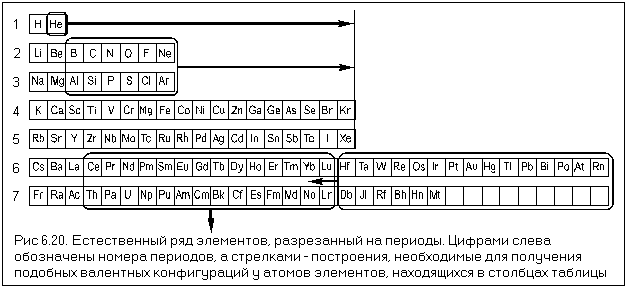
В главных подгруппах Периодической системы химических элементов с ростом заряда ядра радиус атомов. Увеличение заряда ядра атома элемента в главных подгруппах происходит сверху в низ , в этом же направлении идёт увеличение числа энергетических уровней. Чем больше номер периода , в котором находится элемент тем большее число энергетических уровней он имеет.

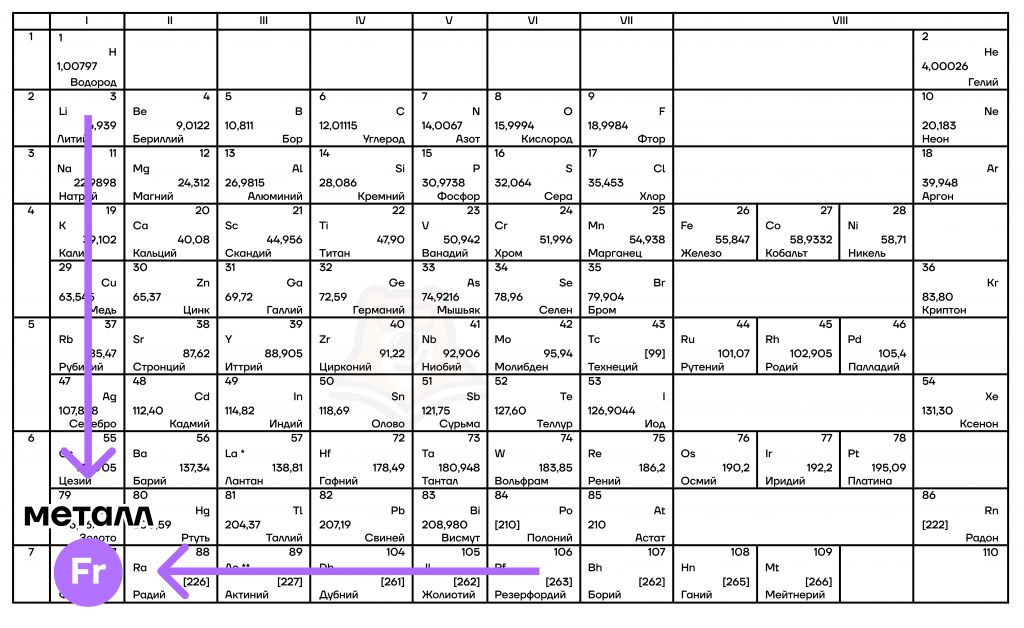
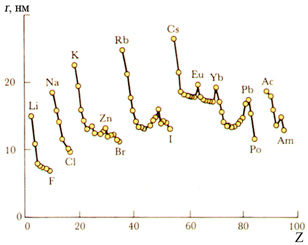


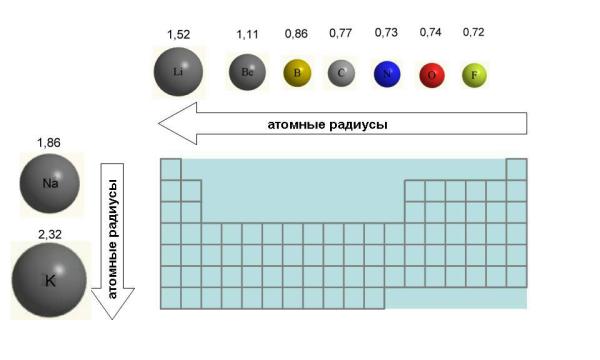


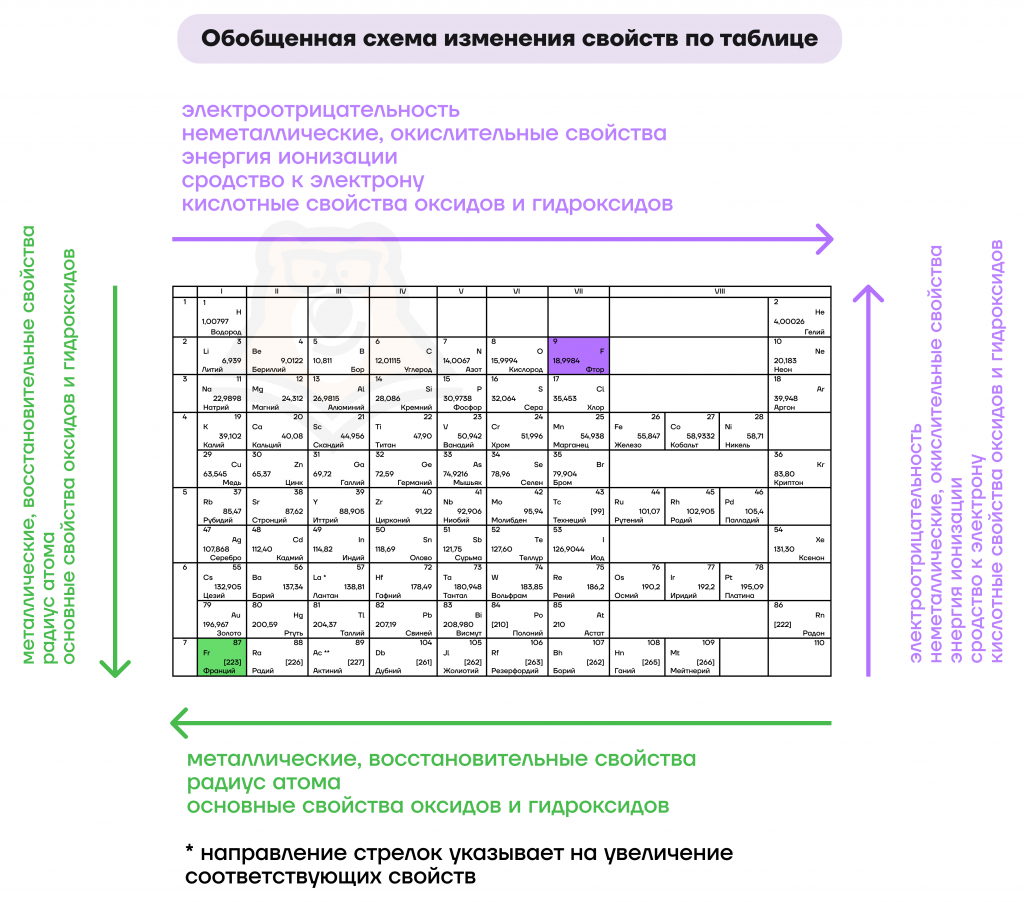
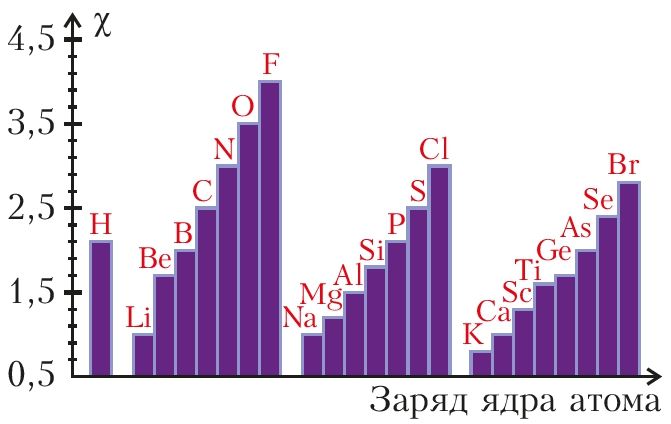
Атом не имеет точного размера, поскольку его электронная плотность сильно размыта. Поэтому радиус атома — условное понятие, зависящее от способа его определения. Различают ковалентные, металлические, ван-дер-ваальсовы и ионные радиусы. К числу важнейших свойств элементов, определяемых электронным строением атома, относятся радиусы атомов и ионов, потенциалы ионизации, сродство к электрону, электроотрицательность, степени окисления элементов. Энергией потенциалом ионизации I называется энергия, которую необходимо затратить для отрыва и удаления электрона от атома, иона или молекулы:.







Поскольку, согласно квантовой механике , атомы не имеют четких границ, а вероятность найти электрон, связанный с ядром данного атома, на определённом расстоянии от этого ядра быстро убывает с увеличением расстояния, атому приписывают некоторый определённый радиус, полагая, что в шаре этого радиуса заключена подавляющая часть электронной плотности порядка 90 процентов. В зависимости от определения термин «радиус атома» может применяться либо только к изолированным атомам, либо также к атомам в конденсированной среде , ковалентно связанным в молекулах или в ионизированном и возбужденном состояниях; его значение может быть получено путем экспериментальных измерений или вычислено из теоретических моделей. Значение радиуса может зависеть от состояния атома и окружающей среды [1]. Электроны не имеют четко определённых орбит или границ.